北京時間9月4日,國際學術期刊Cell在線發(fā)表了中國科學院分子細胞科學卓越創(chuàng)新中心(生物化學與細胞生物學研究所)王開樂研究組和MD安德森癌癥中心Nicholas Navin團隊合作的最新研究成果:“Coalescing single cell genomes and transcriptomes to decode breast cancer progression”。該研究通過開發(fā)高通量單細胞基因組和轉錄組聯(lián)合測序方法wellDR-seq,實現了對12例乳腺癌中超過3萬個單細胞進行雙組學解析。這一突破性研究不僅直接鑒定并表征了ER陽性乳腺癌的腫瘤起始祖先亞克隆,更首次在單細胞水平定量描述了基因拷貝數(DNA)變化與基因表達(RNA)變化之間的復雜劑量調控關系,為乳腺癌的早期診斷、預后判斷和精準治療提供了全新的理論依據和技術路線。
乳腺癌是全球女性中最常見的惡性腫瘤之一,其巨大的臨床異質性使得診斷和治療面臨嚴峻挑戰(zhàn)。乳腺癌有多種亞型,而人的正常乳腺有三種上皮細胞(激素響應型腔面細胞:LumHR、分泌型腔面細胞:LumSec和基底-肌上皮細胞:MyoEpi)。不同亞型的乳腺癌分別是由哪種正常上皮細胞演化而來一直沒有直接證據。正確鑒定不同乳腺癌的起源、以及導致后續(xù)乳腺癌增殖和演化的基因,是攻克乳腺癌的關鍵。然而,由于祖先克隆群體存在比例低,突變少,只有通過高通量、高基因組分辨率的單細胞基因組和轉錄組共測序技術,才能鑒定該群體,并同時獲得該群體的表型,這在技術上一直是個巨大挑戰(zhàn)。
為了克服這一挑戰(zhàn),研究組開發(fā)了高通量、高基因組分辨率的單細胞DNA與RNA聯(lián)合測序方法——wellDR-seq。該方法通過對DNA和RNA的生化反應進行反復優(yōu)化,并結合雙重索引標記技術和納升小孔芯片技術,首次實現了同時對數千個單細胞的基因組和轉錄組進行聯(lián)合測序解析。研究組通過對MDA-MB-231細胞系的雙組學數據分析,發(fā)現僅通過scRNA-seq數據推斷的拷貝數信息并不可靠。這一發(fā)現不僅挑戰(zhàn)了現有的僅依靠單細胞轉錄組分析DNA克隆結構的局限,更強調了直接對DNA和RNA進行聯(lián)合測序在揭示腫瘤真實演化路徑中的不可替代性。
在這項研究中,研究組在4名ER陽性患者中成功識別了腫瘤的祖先亞克隆。這些祖先亞克隆攜帶著少量拷貝數變異(CNAs),隨后在腫瘤進展過程中獲取更多CNAs并大規(guī)模擴增,最終形成了主要的腫瘤細胞群體。通過wellDR-seq,研究人員發(fā)現所有這些祖先細胞都源自LumHR細胞譜系,這表明LumHR細胞是ER陽性乳腺癌的起源細胞。研究人員還發(fā)現在非癌性細胞中也存在偶發(fā)的CNAs。這些CNAs不僅存在于上皮細胞中,也存在于基質細胞中。在上皮細胞中,這些突變細胞主要存在于兩中腔面型(LumSec和LumHR)細胞中,而未在MyoEpi中發(fā)現,且這些突變主要發(fā)生在常染色體上。而存在于基質細胞中的突變主要發(fā)生在X染色體上。這一發(fā)現提示,腔面型上皮更容易導致腫瘤的發(fā)生,為腫瘤發(fā)生的早期預警提供了新的思路。
此外,本研究首次在單細胞層面系統(tǒng)性地量化了基因拷貝數變化對基因表達的影響。研究發(fā)現,在染色體片段水平,56%的CNAs與基因表達變化正相關。在這56%的CNAs中,基因表達量的增加與拷貝數的增加的相關性是接近線性的。出人意料的是,作者通過比較腫瘤亞克隆間的差異表達基因,發(fā)現這些基因絕大多數(69%)都定位于拷貝數沒有變化的區(qū)域,而非拷貝數變化的區(qū)域。另外,作者還發(fā)現在單個基因層面上,拷貝數變化和基因表達變化也存在很大差異。研究將基因分為兩類:“劑量敏感性”基因:如PGR、AURKA和RB1。這些基因的表達水平與拷貝數變化顯著相關,其表達量會隨著基因拷貝數的增減而同步變化。“劑量不敏感性”基因:如PIK3CA、BRCA1和TP53。這些基因的表達水平與拷貝數變化無關。即使基因拷貝數發(fā)生變異,其表達水平仍保持穩(wěn)定。這一發(fā)現為理解腫瘤的遺傳學和功能學提供了新的視角,解釋了為何某些基因突變或拷貝數變異會強烈驅動腫瘤的進展,而另一些則不然。
該研究不僅開發(fā)了高通量的單細胞基因組和轉錄組共測序技術,而且系統(tǒng)解析了乳腺癌的起源并定量表征了基因劑量效應。wellDR-seq是一種通用技術,可被廣泛應用于研究不同腫瘤的起源和演化、研究基因型與表型的互作。除癌癥研究外,wellDR-seq 在生物學和生物醫(yī)學的多個領域都將具有廣泛的應用,包括產前基因檢測、DNA復制、發(fā)育生物學、神經科學、正常組織嵌合體、衰老以及微生物學等。
分子細胞卓越中心王開樂研究員和MD安德森癌癥中心的葉睿博士為該論文的共同第一作者,王開樂研究員和Nicholas Navin教授為共同通訊作者。該項工作得到分子細胞卓越中心細胞高性能計算平臺的幫助和支持。
文章鏈接:https://www.cell.com/cell/abstract/S0092-8674(25)00926-2
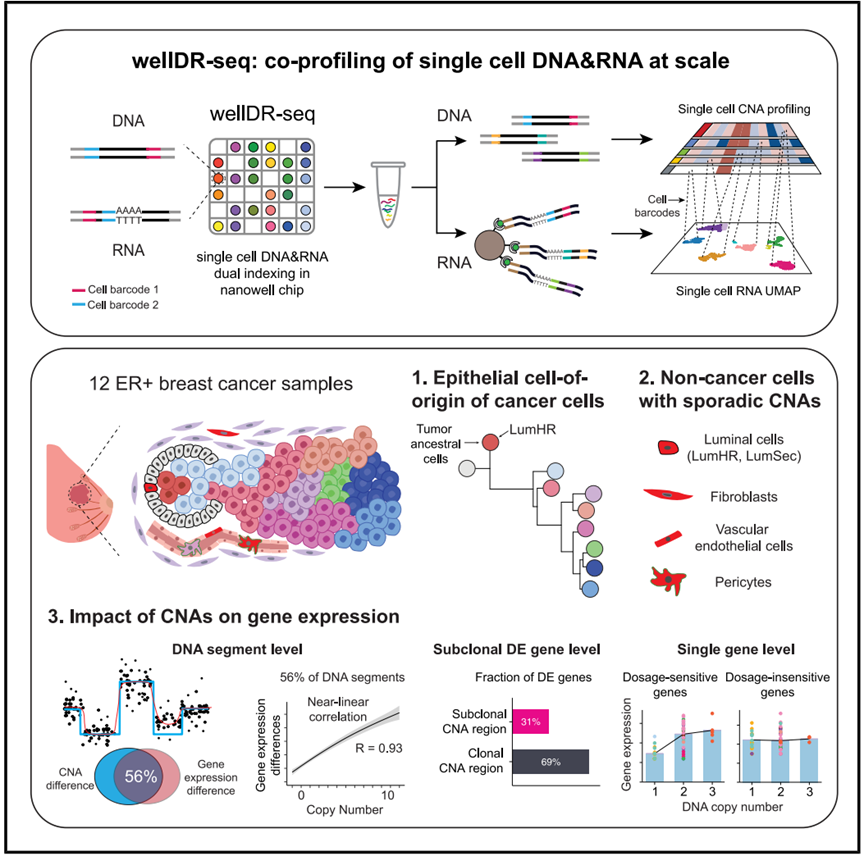
wellDR-seq技術實現乳腺癌樣本的高通量單細胞全基因組與轉錄組的聯(lián)合分析

 日韩欧美精品三级,激情婷婷亚洲,日韩午夜一区,夜夜夜精品看看
主站蜘蛛池模板:
国产精品v一区二区三区|
国产精品一区二区三区乱码|
99精品视频精品精品视频|
久久视频在线观看中文字幕|
日韩一区二区中文|
久久亚洲综合色一区二区三区|
欧美99久久|
婷婷久久综合|
亚洲视频免费在线|
久久综合一区二区三区|
中文一区一区三区免费|
国产精品美女|
郴州新闻综合频道在线直播|
成人综合婷婷国产精品久久免费|
欧美日韩亚洲一区二区三区在线观看
|
欧美永久精品|
色婷婷综合激情|
久久久精品影院|
亚洲综合一区二区|
国产日产欧美一区二区视频|
欧美视频你懂的|
午夜视频久久久|
中文字幕一区二区精品区|
狠狠做六月爱婷婷综合aⅴ|
欧美中文字幕在线|
午夜精品福利一区二区三区蜜桃|
亚洲精品菠萝久久久久久久
|
99精品国产一区二区|
91精品国产高清自在线|
蜜臂av日日欢夜夜爽一区|
精品一区二区在线免费观看|
久久亚洲精品视频|
亚洲欧洲免费视频|
精品一区二区三区视频日产|
欧美大黑bbbbbbbbb在线|
亚洲精品一区久久久久久|
黄色国产精品|
国产精品乱码一区二区三区软件|
中文字幕一区二区三区乱码在线|
欧洲av一区|
8x8x8国产精品|
日韩欧美精品三级,激情婷婷亚洲,日韩午夜一区,夜夜夜精品看看
主站蜘蛛池模板:
国产精品v一区二区三区|
国产精品一区二区三区乱码|
99精品视频精品精品视频|
久久视频在线观看中文字幕|
日韩一区二区中文|
久久亚洲综合色一区二区三区|
欧美99久久|
婷婷久久综合|
亚洲视频免费在线|
久久综合一区二区三区|
中文一区一区三区免费|
国产精品美女|
郴州新闻综合频道在线直播|
成人综合婷婷国产精品久久免费|
欧美日韩亚洲一区二区三区在线观看
|
欧美永久精品|
色婷婷综合激情|
久久久精品影院|
亚洲综合一区二区|
国产日产欧美一区二区视频|
欧美视频你懂的|
午夜视频久久久|
中文字幕一区二区精品区|
狠狠做六月爱婷婷综合aⅴ|
欧美中文字幕在线|
午夜精品福利一区二区三区蜜桃|
亚洲精品菠萝久久久久久久
|
99精品国产一区二区|
91精品国产高清自在线|
蜜臂av日日欢夜夜爽一区|
精品一区二区在线免费观看|
久久亚洲精品视频|
亚洲欧洲免费视频|
精品一区二区三区视频日产|
欧美大黑bbbbbbbbb在线|
亚洲精品一区久久久久久|
黄色国产精品|
国产精品乱码一区二区三区软件|
中文字幕一区二区三区乱码在线|
欧洲av一区|
8x8x8国产精品|