9月10日,國際學術期刊Nature Biotechnology在線發表了中國科學院分子細胞科學卓越創新中心(生物化學與細胞生物學研究所)姜海研究組聯合廈門大學生命科學學院鄧賢明教授團隊的最新研究成果:“A rapid imaging-based screen for induced-proximity degraders identifies a potent degrader of oncoprotein SKP2”。該研究開發了蛋白降解劑的新型高通量篩選平臺,并成功運用該體系發現了靶向泛素連接酶STUB1的新型分子膠降解劑,實現對腫瘤驅動蛋白SKP2的高效清除。
在生物醫藥領域,很多具有明確醫學意義的疾病驅動蛋白屬于傳統認知中的"難以成藥"類型——這類蛋白因缺乏酶活性中心等可靶向的結構特征,一直以來都是抑制劑設計的難點。此類靶點對應著大量未被滿足的臨床需求,而現有靶向藥物卻極為匱乏。針對這一難題,通過分子膠降解劑誘導其靶向降解正成為關鍵突破路徑:該技術無需靶點蛋白具備明確結合口袋,僅借助靶點與細胞內降解機器(如E3泛素連接酶)的界面相互作用即可觸發降解,對蛋白結構特性要求顯著降低,被視為攻克"不可靶向"靶點的核心策略。分子膠降解劑也已成為學界與工業界近年的研發焦點。
然而,該領域長期受制于一個關鍵瓶頸:分子膠降解劑的發現高度依賴偶然性,缺乏系統高效的篩選體系。為破解這一難題,姜海研究組開發了新型高通量篩選平臺。降解劑篩選方法的困境在于:化合物誘導目標蛋白降解的本質是細胞內的微觀分子事件,本身不產生可直接觀測的宏觀表型。對此,姜海團隊設計了一種低成本、易操作的自動化篩選體系——通過將疾病靶點蛋白與條件性自殺蛋白FKBP12 F36V-CASP9融合,并利用病毒載體構建穩定表達細胞系。該設計的核心邏輯是:當條件性自殺蛋白被激活時,細胞將在數小時內完全死亡;而若篩選化合物能成功降解目標蛋白(連帶降解與之融合的自殺蛋白),則細胞在加入激活劑前已無自殺蛋白存在,可維持正常存活。由此,原本不可見的蛋白降解過程被轉化為清晰的"死亡-存活"宏觀表型,通過384孔板的自動化明場成像,即可發現具有細胞存活的細胞孔并鎖定潛在降解劑,再通過Western blot等技術驗證。基于這一DEFUSE(DEath FUSion Escaper)篩選體系,研究人員可在一周內完成上萬個化合物對數十個靶點蛋白的篩選,不僅大幅提升了效率,更以低成本、高靈敏度特性為蛋白靶向降解研究提供了通用工具。
利用該體系,姜海團隊與鄧賢明團隊合作,從化合物庫中篩選出腫瘤驅動蛋白SKP2的小分子降解劑SKPer1。深入研究表明,SKPer1屬于新型分子膠降解劑,其作用機制是通過介導SKP2與泛素連接酶STUB1的空間鄰近,進而引發SKP2的泛素化降解。實驗顯示,SKPer1能特異性殺傷SKP2高表達的癌細胞系,在小鼠腫瘤模型中同時表現出良好的安全性與顯著抑瘤效果。
該研究為"不可成藥"的SKP2靶點提供了全新拮抗策略和藥物開發路徑,并將廣譜表達的泛素連接酶STUB1引入分子膠降解領域,拓展了降解機器的應用范圍。該研究還開發了一種基于SKP2序列的10氨基酸短肽標簽——將該標簽與MYC、KRAS等靶標蛋白融合后,SKPer1可將其定向招募至STUB1附近實現降解。這一標簽技術為蛋白降解研究及基因功能探索提供了便捷工具。
分子細胞卓越中心姜海研究員和廈門大學生命科學學院鄧賢明教授團隊為該論文的共同通訊作者。分子細胞卓越中心博士后褚衍凱、博士生陳奭爽、陳寅、方慧玲及廈門大學生命科學學院博士生陽明洋為論文的共同第一作者。該研究得到分子細胞卓越中心化學生物學技術平臺、細胞分析技術平臺、分子生物學技術平臺和動物實驗技術平臺的支持。該項研究得到了國家重點研發計劃、中國科學院戰略性先導科技專項、國家自然科學基金等的資助。
文章鏈接:https://www.nature.com/articles/s41587-025-02793-8
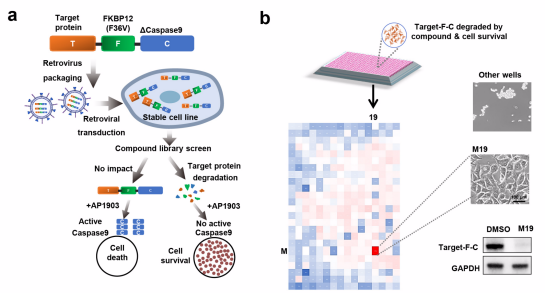
高通量篩選平臺示意圖

 日韩欧美精品三级,激情婷婷亚洲,日韩午夜一区,夜夜夜精品看看
主站蜘蛛池模板:
国产精品欧美一区二区|
亚洲成人精选|
91久久久久久久久久久|
亚洲欧美日产图|
亚洲精品mp4|
日韩精品1区2区3区|
青青草国产成人a∨下载安卓|
亚洲国产一区二区三区在线播放|
午夜精品视频在线观看一区二区|
精品欧美一区二区久久|
91九色精品国产一区二区|
国产精品亚洲第一区在线暖暖韩国|
亚洲丁香婷深爱综合|
亚洲欧美综合|
欧美国产免费|
午夜精品久久久久久久|
久久久久久中文字幕|
99re久久最新地址获取|
国产影视一区|
欧美在线视频播放|
国产成人三级|
精品免费日产一区一区三区免费
|
怕怕欧美视频免费大全|
国产精品视频免费|
欧美日韩免费网站|
国产欧美精品日韩区二区麻豆天美|
午夜精品久久久久久久99热浪潮
|
精品二区久久|
日韩欧美1区|
日韩精品一区二区三区免费观影
|
日韩国产一区二区|
国产精品久久久久永久免费观看|
亚洲国产日韩av|
狠狠操狠狠色综合网|
九九亚洲视频|
亚洲国产成人精品女人
|
欧美色图激情小说|
精品欧美久久|
99re成人精品视频|
蜜桃一区二区|
日韩av在线一区二区|
日韩欧美精品三级,激情婷婷亚洲,日韩午夜一区,夜夜夜精品看看
主站蜘蛛池模板:
国产精品欧美一区二区|
亚洲成人精选|
91久久久久久久久久久|
亚洲欧美日产图|
亚洲精品mp4|
日韩精品1区2区3区|
青青草国产成人a∨下载安卓|
亚洲国产一区二区三区在线播放|
午夜精品视频在线观看一区二区|
精品欧美一区二区久久|
91九色精品国产一区二区|
国产精品亚洲第一区在线暖暖韩国|
亚洲丁香婷深爱综合|
亚洲欧美综合|
欧美国产免费|
午夜精品久久久久久久|
久久久久久中文字幕|
99re久久最新地址获取|
国产影视一区|
欧美在线视频播放|
国产成人三级|
精品免费日产一区一区三区免费
|
怕怕欧美视频免费大全|
国产精品视频免费|
欧美日韩免费网站|
国产欧美精品日韩区二区麻豆天美|
午夜精品久久久久久久99热浪潮
|
精品二区久久|
日韩欧美1区|
日韩精品一区二区三区免费观影
|
日韩国产一区二区|
国产精品久久久久永久免费观看|
亚洲国产日韩av|
狠狠操狠狠色综合网|
九九亚洲视频|
亚洲国产成人精品女人
|
欧美色图激情小说|
精品欧美久久|
99re成人精品视频|
蜜桃一区二区|
日韩av在线一区二区|