3月31日,國際學(xué)術(shù)期刊 Nature Biotechnology 在線發(fā)表了中國科學(xué)院分子細(xì)胞科學(xué)卓越創(chuàng)新中心(生物化學(xué)與細(xì)胞生物學(xué)研究所)陳玲玲研究組的研究成果:“Circular RNA aptamers targeting neuroinflammation ameliorate Alzheimer’s disease phenotypes in mouse models”。該研究揭示了雙鏈RNA依賴的蛋白激酶R(Protein Kinase R, PKR)在阿爾茨海默病(Alzheimer’s disease, AD)發(fā)生與進(jìn)展過程中異常激活的分子病理特征,并創(chuàng)新性地開發(fā)了一種基于具有分子內(nèi)短雙鏈結(jié)構(gòu)環(huán)形RNA(short double-stranded region-containing circular RNAs, ds-cRNA)抑制PKR異常激活的策略,從而緩解AD癥狀,為臨床治療提供了新的思路。
AD是一種以淀粉樣蛋白(Aβ)沉積、Tau蛋白過度磷酸化及神經(jīng)炎癥為主要特征的神經(jīng)退行性疾病。現(xiàn)有的治療策略主要聚焦于Aβ斑塊的清除,針對神經(jīng)炎癥的干預(yù)手段仍然有限。研究發(fā)現(xiàn),PKR在AD患者及AD小鼠模型中呈異常激活狀態(tài),并與神經(jīng)炎癥及神經(jīng)元損失密切相關(guān)。然而,傳統(tǒng)的PKR小分子抑制劑因特異性較差、毒副作用高,難以在臨床推廣應(yīng)用。前期研究表明,ds-cRNA可與PKR結(jié)合并抑制其異常激活,顯示出其作為新型RNA療法用于AD治療的潛力。
陳玲玲團(tuán)隊的前期研究發(fā)現(xiàn),含有 16-26bp 不完美 RNA 雙鏈結(jié)構(gòu)的環(huán)形 RNA(ds-cRNA)能夠結(jié)合 PKR 并抑制其激活(Cell, 2019; Molecular Cell, 2022)。體外合成的 ds-cRNA 經(jīng)納米顆粒包裹遞送后,可有效抑制銀屑病模型小鼠的炎癥反應(yīng)并改善其皮損表型(Nature Biotechnology, 2024),驗證了 ds-cRNA 在體內(nèi)遞送的安全性和有效性。
在本研究中,研究團(tuán)隊利用兩種不同小鼠模型——5×FAD(以Aβ沉積為主要病理特征)和PS19(以Tau蛋白過度磷酸化為主要病理特征)——系統(tǒng)分析了PKR活性的動態(tài)變化。結(jié)果表明,隨著疾病進(jìn)展,PKR的磷酸化水平顯著升高,并與神經(jīng)炎癥及AD病理表現(xiàn)呈正相關(guān)。值得注意的是,PKR基因敲除可顯著改善小鼠的空間記憶能力。此外,與傳統(tǒng)的小分子抑制劑C16相比,ds-cRNA能夠高效結(jié)合PKR的雙鏈RNA結(jié)合域,特異性抑制PKR的異常激活,且未表現(xiàn)出顯著毒性。
研究團(tuán)隊進(jìn)一步通過腺相關(guān)病毒(AAV)介導(dǎo)的遞送方式,將ds-cRNA靶向表達(dá)于神經(jīng)元和小膠質(zhì)細(xì)胞,發(fā)現(xiàn)海馬區(qū)域的Aβ斑塊及磷酸化Tau蛋白沉積顯著減少,神經(jīng)元損失降低約2倍。單次給藥后,治療效果可持續(xù)至少6個月。此外,在AD早期及晚期模型中,ds-cRNA治療均能顯著改善小鼠的空間記憶能力。RNA測序分析顯示,ds-cRNA通過抑制PKR激活,降低小膠質(zhì)細(xì)胞的炎癥通路,同時恢復(fù)突觸功能相關(guān)基因的表達(dá),從而緩解神經(jīng)炎癥并改善AD病理表型(圖1)。
綜上,該研究闡明了PKR異常激活在AD病理中的關(guān)鍵作用,并驗證了ds-cRNA作為新型RNA療法的潛在應(yīng)用價值。通過靶向抑制PKR的異常激活,該策略有效緩解了神經(jīng)炎癥,并改善了AD的病理表型及認(rèn)知功能,為AD的RNA治療提供了新的策略,展現(xiàn)出其潛在的臨床應(yīng)用前景。
分子細(xì)胞卓越中心馮昕博士和姜博文博士為該論文的共同第一作者,陳玲玲研究員為該論文的通訊作者。復(fù)旦大學(xué)生物醫(yī)學(xué)研究院楊力研究員對該項工作給予了大力支持。該項工作獲得國家自然科學(xué)基金、科技部、中國科學(xué)院、上海市科委、上海自然科學(xué)研究院以及新基石科學(xué)基金會的支持,并獲得分子細(xì)胞科學(xué)卓越創(chuàng)新中心分子生物學(xué)技術(shù)平臺、細(xì)胞分析技術(shù)平臺和動物實驗技術(shù)平臺的幫助與支持。
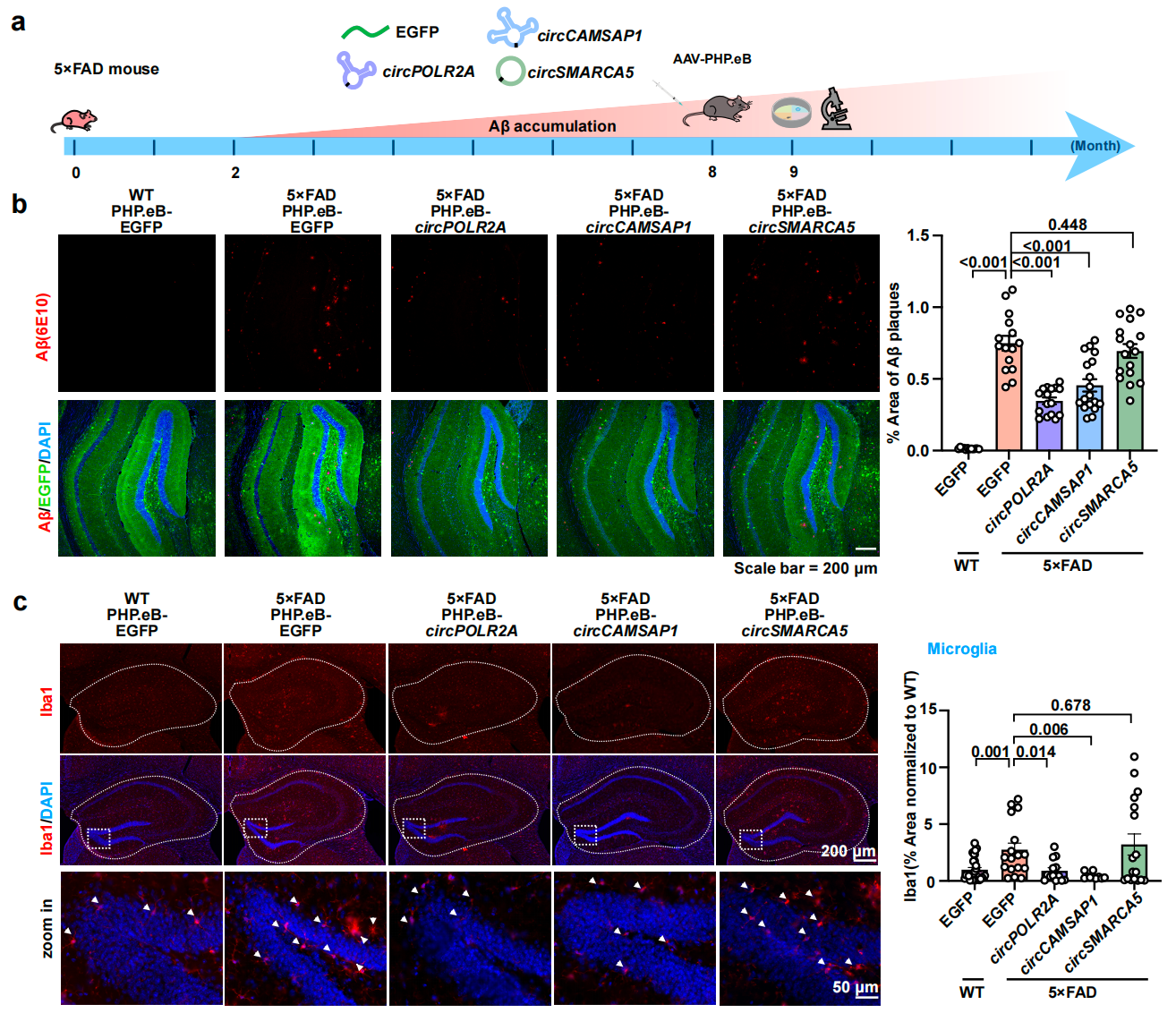
圖1. AAV遞送的ds-cRNA在5xFAD小鼠海馬組織中減少Aβ斑沉積,抑制膠質(zhì)細(xì)胞增殖。
文章鏈接:https://www.nature.com/articles/s41587-025-02624-w

































 主站蜘蛛池模板:
乌拉特中旗|
新乡县|
中牟县|
富源县|
大埔区|
上思县|
佛学|
丰镇市|
新巴尔虎左旗|
五家渠市|
曲周县|
唐海县|
嘉善县|
吴桥县|
白山市|
新竹市|
奎屯市|
响水县|
克拉玛依市|
卢湾区|
民丰县|
西华县|
黔东|
安新县|
子长县|
栾川县|
洛宁县|
辽中县|
图片|
色达县|
桂林市|
马鞍山市|
登封市|
沂南县|
斗六市|
丰都县|
沂水县|
岑溪市|
遂昌县|
普宁市|
江安县|
主站蜘蛛池模板:
乌拉特中旗|
新乡县|
中牟县|
富源县|
大埔区|
上思县|
佛学|
丰镇市|
新巴尔虎左旗|
五家渠市|
曲周县|
唐海县|
嘉善县|
吴桥县|
白山市|
新竹市|
奎屯市|
响水县|
克拉玛依市|
卢湾区|
民丰县|
西华县|
黔东|
安新县|
子长县|
栾川县|
洛宁县|
辽中县|
图片|
色达县|
桂林市|
马鞍山市|
登封市|
沂南县|
斗六市|
丰都县|
沂水县|
岑溪市|
遂昌县|
普宁市|
江安县|