磷是維持人體生命活動(dòng)的必需元素,在核酸構(gòu)成、能量代謝、信號傳導(dǎo)及骨骼發(fā)育等生理過程中發(fā)揮關(guān)鍵作用。細(xì)胞內(nèi)磷酸鹽的攝入對生命活動(dòng)至關(guān)重要,但是過量的磷酸鹽積累會(huì)與鈣、鎂、鐵等離子沉積,帶來細(xì)胞和組織毒性,需要外排機(jī)制及時(shí)平衡。XPR1是目前人體唯一已知的磷酸鹽外排蛋白,其功能異常與腦鈣化、血栓形成、腫瘤發(fā)生等多種疾病密切相關(guān)。在原發(fā)性基底節(jié)腦鈣化癥中,XPR1功能失調(diào)導(dǎo)致磷酸鹽外排障礙,進(jìn)而形成鈣磷沉積,最終誘發(fā)神經(jīng)系統(tǒng)病變[1]。在細(xì)胞內(nèi)XPR1的功能可被磷酸鹽濃度指示分子焦磷酸肌醇InsP8激活[2]。同時(shí),支架蛋白KIDINS220能與XPR1形成復(fù)合物調(diào)控磷酸鹽的外排[3]。但是KIDINS220和InsP8調(diào)控XPR1功能的分子機(jī)制并不清晰,阻礙了我們對XPR1功能失調(diào)引起的腦鈣化等疾病發(fā)生機(jī)理的理解。
近日,中國科學(xué)院上海有機(jī)化學(xué)研究所生物與化學(xué)交叉研究中心、生命過程小分子調(diào)控國家重點(diǎn)實(shí)驗(yàn)室張一小課題組,聯(lián)合澳大利亞國立大學(xué)Ben Corry課題組、上海科技大學(xué)孫亞東課題組以及美國國立環(huán)境健康科學(xué)研究所Stephen Shears課題組,在Molecular Cell雜志上發(fā)表了題為“KIDINS220 and InsP8 safeguard the stepwise regulation of phosphate exporter XPR1”的研究文章。該研究通過結(jié)構(gòu)解析、功能研究、計(jì)算模擬等手段揭示了XPR1一種精細(xì)的“key-to-locks”活性調(diào)控方式,以及一種獨(dú)特的“knock-kiss-kick”磷酸轉(zhuǎn)運(yùn)外排機(jī)制,闡明了原發(fā)性腦鈣化相關(guān)突變的致病機(jī)理,并發(fā)現(xiàn)了磷酸外排同源蛋白XPR1、PXo、PHO1在進(jìn)化上的保守性和差異性。


圖1. XPR1–KIDINS220復(fù)合物結(jié)構(gòu)及InsP8激活XPR1的全構(gòu)象變化過程
“Key-to-locks”活性調(diào)控方式:本研究通過冷凍電鏡解析了XPR1與神經(jīng)元支架蛋白KIDINS220復(fù)合物以及XPR1與InsP8復(fù)合物的高分辨三維結(jié)構(gòu),捕捉到XPR1激活過程中的多種功能狀態(tài)。結(jié)合功能實(shí)驗(yàn),本研究發(fā)現(xiàn)KIDINS220能將XPR1穩(wěn)定在關(guān)閉狀態(tài),存在多重限制機(jī)制來給磷酸鹽外排活性上“鎖”。而天然底物InsP8,這一分子猶如“鑰匙”,能夠誘發(fā)XPR1的逐步激活:(1)在關(guān)閉狀態(tài)中,KIDINS220能夠與XPR1的不同基序結(jié)合,將XPR1的SPX結(jié)構(gòu)域牢牢鎖定在非翻轉(zhuǎn)的關(guān)閉狀態(tài)。其中,XPR1的α1螺旋形成interaction hub來穩(wěn)定該構(gòu)象。只有在InsP8存在并與XPR1的α1螺旋結(jié)合時(shí),這一限制及其他內(nèi)部約束才能被解除;(2) 在關(guān)閉狀態(tài)中,XPR1的C-loop形成“蓋子”,遮擋住胞內(nèi)入口。InsP8誘導(dǎo)SPX結(jié)構(gòu)域發(fā)生逐步構(gòu)象重排,并發(fā)生180度的大翻轉(zhuǎn)。翻轉(zhuǎn)后的SPX暴露出與C-loop的結(jié)合界面,將胞內(nèi)入口打開,從而解除第二重限制;(3)XPR1的TM9b螺旋控制著外側(cè)出口,當(dāng)TM9b向外運(yùn)動(dòng)并擴(kuò)大外側(cè)通道時(shí),磷酸基團(tuán)才能順利轉(zhuǎn)運(yùn)至胞外(圖1)。綜上所述,XPR1的激活需要依次解除由KIDINS220、α1螺旋、C-loop和TM9b螺旋等形成的多重限制,從而實(shí)現(xiàn)孔道開放,這一“key-to-locks”機(jī)制揭示了XPR1活性的精細(xì)調(diào)控模式。
“Knock-kiss-kick”磷酸轉(zhuǎn)運(yùn)外排機(jī)制:通過對電鏡數(shù)據(jù)的細(xì)致計(jì)算分析,研究人員發(fā)現(xiàn)XPR1胞內(nèi)和胞外開口的開放是獨(dú)立的,捕捉到了磷酸鹽外排通道“關(guān)/關(guān)(內(nèi)/外),開/關(guān),關(guān)/開,開/開”四種不同的構(gòu)象,這種互不耦聯(lián)的轉(zhuǎn)運(yùn)模式與傳統(tǒng)的轉(zhuǎn)運(yùn)蛋白完全不同。值得注意的是,在這四種構(gòu)象下,在轉(zhuǎn)運(yùn)通道內(nèi)部均存在著一處非常狹窄的constriction site,即使是在“開/開”構(gòu)象下,磷酸鹽也難以通過。結(jié)合磷酸基團(tuán)的相互作用分析及分子動(dòng)力學(xué)模擬,研究人員發(fā)現(xiàn)了磷酸鹽在通道內(nèi)經(jīng)歷了一個(gè)獨(dú)特的外排過程:磷酸鹽首先通過靜電互斥,將constriction site附近的負(fù)電氨基酸向外推,將“門”敲開(knock),隨后在由多個(gè)帶正電氨基酸構(gòu)成的磷酸結(jié)合口袋內(nèi)短暫停留(kiss),附近帶負(fù)電及極性氨基酸平衡上述正電口袋的電性,削弱結(jié)合能力,口袋中結(jié)合的磷酸鹽短暫停留后被下一個(gè)進(jìn)入口袋的磷酸鹽向外踢出(kick),最終完成轉(zhuǎn)運(yùn)。基于此,本研究提出了一種新穎的“knock–kiss–kick”模型,用以描述XPR1介導(dǎo)的磷酸外排機(jī)制。
原發(fā)性家族性腦鈣化癥(PFBC)相關(guān)突變的致病機(jī)理:本研究不僅揭示了XPR1的正常調(diào)控機(jī)制,還為理解腦疾病提供了分子層面的解釋。PFBC患者中常見的致病突變(如R459C、R570L等)[1, 4]位于XPR1通道內(nèi)的關(guān)鍵識別和門控區(qū)域。本研究解析了R459C、R570L這兩種突變體的結(jié)構(gòu),意外發(fā)現(xiàn)R459C呈現(xiàn)出類似于InsP8結(jié)合的激活態(tài)構(gòu)象特征:SPX發(fā)生翻轉(zhuǎn),胞內(nèi)側(cè)入口開放;而R570L則穩(wěn)定于向外開放的構(gòu)象。然而,這些突變雖然具有XPR1激活開放的構(gòu)象特征,但是改變了通道內(nèi)部的環(huán)境,使得磷酸鹽無法正常結(jié)合和轉(zhuǎn)運(yùn),顯著削弱了外排能力,最終導(dǎo)致鈣磷沉積。本研究為由XPR1功能失調(diào)引起的腦鈣化發(fā)病機(jī)制提供了直接的分子闡釋。
XPR1同源蛋白進(jìn)化的保守性和差異性:XPR1的同源蛋白PHO1和PXo分別在植物和果蠅中發(fā)揮調(diào)節(jié)磷酸穩(wěn)態(tài)的重要作用。本研究通過結(jié)構(gòu)解析發(fā)現(xiàn),XPR1與PHO1、PXo在結(jié)構(gòu)上高度相似,但也存在顯著差異: PXo始終保持外側(cè)開口開放,且InsP6或InsP8均無法使其SPX結(jié)構(gòu)域穩(wěn)定,這提示PXo可能具有不同的激活調(diào)控機(jī)制。在解析PHO1結(jié)構(gòu)時(shí),本研究發(fā)現(xiàn)其兩個(gè)單體呈現(xiàn)不對稱分布,但這一特征與其功能之間的關(guān)系尚需進(jìn)一步研究。這些結(jié)果提示,磷酸外排機(jī)制在不同物種中經(jīng)歷了保守與分化的雙重進(jìn)化。
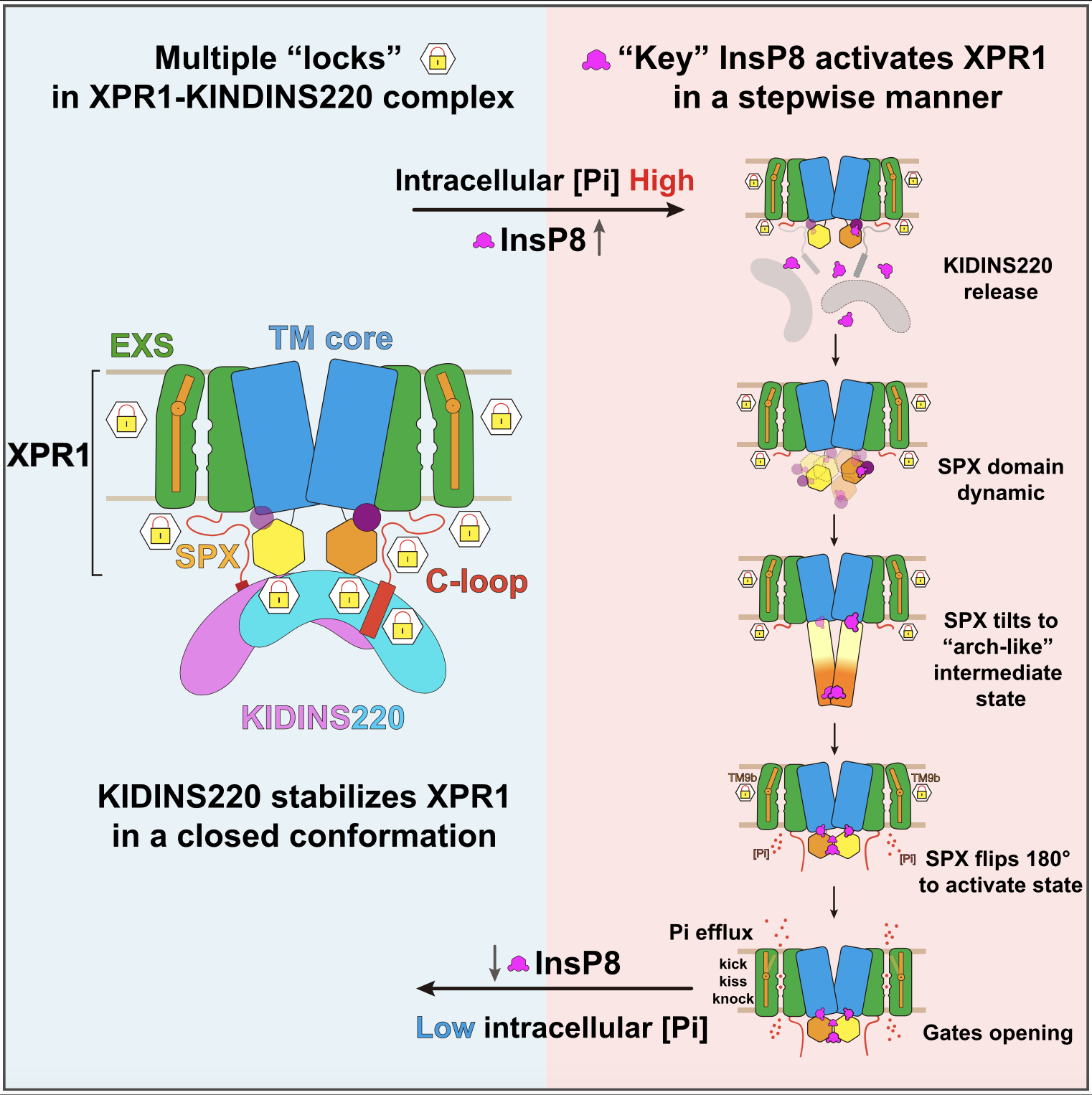
圖2.KIDINS220和InsP8調(diào)控XPR1磷酸鹽轉(zhuǎn)運(yùn)活性的模型
總體來講,本研究完整描繪了XPR1的逐步激活過程,并提出了兩個(gè)新穎模型:“key-to-locks”揭示了InsP8如何解除KIDINS220及XPR1自身施加的多重抑制,“knock–kiss–kick”描述了磷酸鹽的外排過程(圖2)。這些發(fā)現(xiàn)不僅為理解人類磷酸鹽穩(wěn)態(tài)提供了分子基礎(chǔ),也為腦鈣化、腫瘤等疾病的致病機(jī)理研究及潛在干預(yù)策略開辟了新方向。
中國科學(xué)院上海有機(jī)化學(xué)研究所生物與化學(xué)交叉研究中心博士研究生王曉捷、柏忠諫,澳大利亞國立大學(xué)博士研究生Ciara Wallis為共同第一作者。張一小研究員, Ben Corry教授, 孫亞東教授, Stephen Shears教授為本文通訊作者。第二軍醫(yī)大學(xué)楊田教授、杭州師范大學(xué)雷明光教授以及本文其他作者亦做出了重要貢獻(xiàn)。該工作得到了科技部科技創(chuàng)新2030-“腦科學(xué)與類腦研究”重大項(xiàng)目、國家自然科學(xué)基金海外優(yōu)青項(xiàng)目、中國科學(xué)院上海分院青年英才培育計(jì)劃,以及上海市科委的資助。
張一小研究員長期招聘細(xì)胞生物學(xué)、藥物化學(xué)、生物化學(xué)和結(jié)構(gòu)生物學(xué)方向博士后和科研助理,歡迎申請 (yzhang@@@sioc.ac.cn)。
原文鏈接:https://doi.org/10.1016/j.molcel.2025.08.003
參考文獻(xiàn):
1. Lopez-Sanchez, U., et al., Characterization of XPR1/SLC53A1 variants located outside of the SPX domain in patients with primary familial brain calcification. Sci Rep, 2019. 9(1): p. 6776.
2. Li, X., et al., Control of XPR1-dependent cellular phosphate efflux by InsP(8) is an exemplar for functionally-exclusive inositol pyrophosphate signaling. Proc Natl Acad Sci U S A, 2020. 117(7): p. 3568–3574.
3. Bondeson, D.P., et al., Phosphate dysregulation via the XPR1-KIDINS220 protein complex is a therapeutic vulnerability in ovarian cancer. Nat Cancer, 2022. 3(6): p. 681–695.
4. Orimo, K., et al., A Japanese family with idiopathic basal ganglia calcification carrying a novel XPR1 variant. J Neurol Sci, 2023. 451: p. 120732.



































 日韩欧美精品三级,激情婷婷亚洲,日韩午夜一区,夜夜夜精品看看
主站蜘蛛池模板:
久久国产精品久久久久久电车|
欧美在线观看一区二区|
91精品国产自产91精品|
午夜精品久久久久久久四虎美女版
|
国产免费久久|
国产精品一区二区三区av麻|
国产日韩精品入口|
欧美日韩国产乱码电影|
日韩精品成人一区二区三区|
久久深夜福利免费观看|
性欧美69xoxoxoxo|
一区二区亚洲|
国产又爽又黄的激情精品视频|
精品免费一区二区三区蜜桃|
日韩精品一区二区三区免费观影|
久久精品国产大片免费观看|
婷婷久久国产对白刺激五月99|
久久久久久久久久久一区|
中文一区在线|
欧美久久综合|
国产精品99精品久久免费|
亚洲精品小说|
狠狠综合久久|
欧美成人激情视频|
亚洲精品在线观看91|
国产日韩久久|
日韩欧美在线不卡|
亚洲欧美日韩中文字幕一区二区三区|
国产videos久久|
日韩欧美国产一区二区三区|
久久久久久久久蜜桃|
国产亚洲欧美日韩在线观看一区二区
|
日韩中文字幕网|
亚洲精品乱码久久久久|
加勒比久久综合|
国产精品久久久久久久小唯西川|
一区二区日韩精品|
欧美一区网站|
亚洲最新av|
日韩在线国产|
蜜桃999成人看片在线观看|
日韩欧美精品三级,激情婷婷亚洲,日韩午夜一区,夜夜夜精品看看
主站蜘蛛池模板:
久久国产精品久久久久久电车|
欧美在线观看一区二区|
91精品国产自产91精品|
午夜精品久久久久久久四虎美女版
|
国产免费久久|
国产精品一区二区三区av麻|
国产日韩精品入口|
欧美日韩国产乱码电影|
日韩精品成人一区二区三区|
久久深夜福利免费观看|
性欧美69xoxoxoxo|
一区二区亚洲|
国产又爽又黄的激情精品视频|
精品免费一区二区三区蜜桃|
日韩精品一区二区三区免费观影|
久久精品国产大片免费观看|
婷婷久久国产对白刺激五月99|
久久久久久久久久久一区|
中文一区在线|
欧美久久综合|
国产精品99精品久久免费|
亚洲精品小说|
狠狠综合久久|
欧美成人激情视频|
亚洲精品在线观看91|
国产日韩久久|
日韩欧美在线不卡|
亚洲欧美日韩中文字幕一区二区三区|
国产videos久久|
日韩欧美国产一区二区三区|
久久久久久久久蜜桃|
国产亚洲欧美日韩在线观看一区二区
|
日韩中文字幕网|
亚洲精品乱码久久久久|
加勒比久久综合|
国产精品久久久久久久小唯西川|
一区二区日韩精品|
欧美一区网站|
亚洲最新av|
日韩在线国产|
蜜桃999成人看片在线观看|