2025年5月14日,中國科學(xué)院上海藥物研究所徐華強(qiáng)與徐有偉研究團(tuán)隊(duì),結(jié)合分子生物學(xué)和冷凍電鏡技術(shù),成功解析了人源前列腺素E2(Prostaglandin E2,PGE2)與其受體EP1及異源三聚體Gq蛋白復(fù)合物的高分辨率結(jié)構(gòu),揭示了PGE2識(shí)別并激活EP1受體的分子機(jī)制。相關(guān)研究成果以“Structural insights into the activation of the human prostaglandin E2 receptor EP1 subtype by prostaglandin E2”為題發(fā)表于《美國國家科學(xué)院院刊》(PNAS)。
前列腺素E2是一種源自花生四烯酸代謝的內(nèi)源性脂質(zhì)分子,參與炎癥反應(yīng)、血管舒張、痛覺感知等多種生理過程。其通過結(jié)合EP1-EP4四種亞型的G蛋白偶聯(lián)受體(GPCRs)發(fā)揮功能。盡管EP2、EP3和EP4與PGE2及G蛋白的復(fù)合物結(jié)構(gòu)已相繼被解析,EP1受體由于其結(jié)構(gòu)不穩(wěn)定性,始終未能獲得高分辨率結(jié)構(gòu),嚴(yán)重制約了對其信號機(jī)制的深入理解。
為解決這一難題,研究團(tuán)隊(duì)以冷凍電鏡技術(shù)獲得了分辨率為2.55 ?的人源PGE2-EP1-Gq復(fù)合物三維結(jié)構(gòu),系統(tǒng)解析了PGE2如何被EP1識(shí)別并激活下游信號通路。研究發(fā)現(xiàn),EP1在激活過程中第六跨膜螺旋(TM6)的位移幅度明顯小于其他亞型受體,提示其具有獨(dú)特的構(gòu)象變化與激活模式。
比較分析表明,EP1在與Gq蛋白偶聯(lián)時(shí)展現(xiàn)出前列腺素家族中既保守又特異的模式。研究鑒定出11個(gè)在Gq偶聯(lián)中高度保守的關(guān)鍵殘基,同時(shí)也發(fā)現(xiàn)EP1獨(dú)特的未參與Gq相互作用的殘基,凸顯不同受體之間偶聯(lián)機(jī)制的差異性。
值得一提的是,徐華強(qiáng)課題組在前列腺素受體領(lǐng)域開展了系統(tǒng)性研究,先后解析了多個(gè)前列腺素受體的三維結(jié)構(gòu),包括FP2α受體(Nature Communications,2023)、TP受體(Science Advances,2024)和DP2受體(PNAS,2024)。該研究不僅首次揭示了EP1受體激活及Gq蛋白偶聯(lián)的分子機(jī)制,填補(bǔ)了前列腺素受體家族結(jié)構(gòu)信息的空白,也為開發(fā)靶向EP1受體的高選擇性藥物奠定了重要的結(jié)構(gòu)基礎(chǔ)。
上海市高峰電鏡中心負(fù)責(zé)了該項(xiàng)研究冷凍電鏡數(shù)據(jù)的收集。上海藥物所碩士研究生孟雪為本論文第一作者。上海藥物所徐華強(qiáng)研究員和徐有偉為本論文共同通訊作者。上海藥物所為本研究的第一完成單位。該工作獲得了國家自然科學(xué)基金委、科技部、中國科學(xué)院先導(dǎo)專項(xiàng)以及上海市市級科技重大專項(xiàng)等項(xiàng)目的資助。
全文鏈接:https://www.pnas.org/doi/10.1073/pnas.2423840122
?
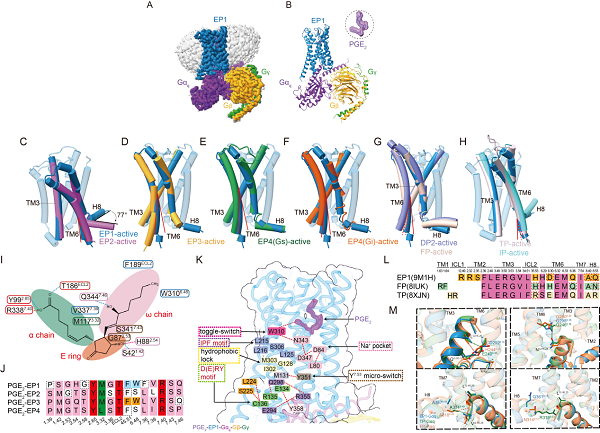
圖片說明:PGE2結(jié)合并激活EP1受體的獨(dú)特機(jī)制

































 主站蜘蛛池模板:
安丘市|
平安县|
尖扎县|
英吉沙县|
柳河县|
平利县|
安多县|
天长市|
娱乐|
无为县|
青铜峡市|
长治县|
璧山县|
沙坪坝区|
津市市|
元氏县|
广德县|
陵水|
四会市|
凤山县|
巴里|
三原县|
岑巩县|
巨鹿县|
凤山县|
东台市|
肇东市|
家居|
雷山县|
汪清县|
讷河市|
湟中县|
利川市|
天台县|
东丰县|
南阳市|
凭祥市|
保定市|
白水县|
游戏|
香格里拉县|
主站蜘蛛池模板:
安丘市|
平安县|
尖扎县|
英吉沙县|
柳河县|
平利县|
安多县|
天长市|
娱乐|
无为县|
青铜峡市|
长治县|
璧山县|
沙坪坝区|
津市市|
元氏县|
广德县|
陵水|
四会市|
凤山县|
巴里|
三原县|
岑巩县|
巨鹿县|
凤山县|
东台市|
肇东市|
家居|
雷山县|
汪清县|
讷河市|
湟中县|
利川市|
天台县|
东丰县|
南阳市|
凭祥市|
保定市|
白水县|
游戏|
香格里拉县|