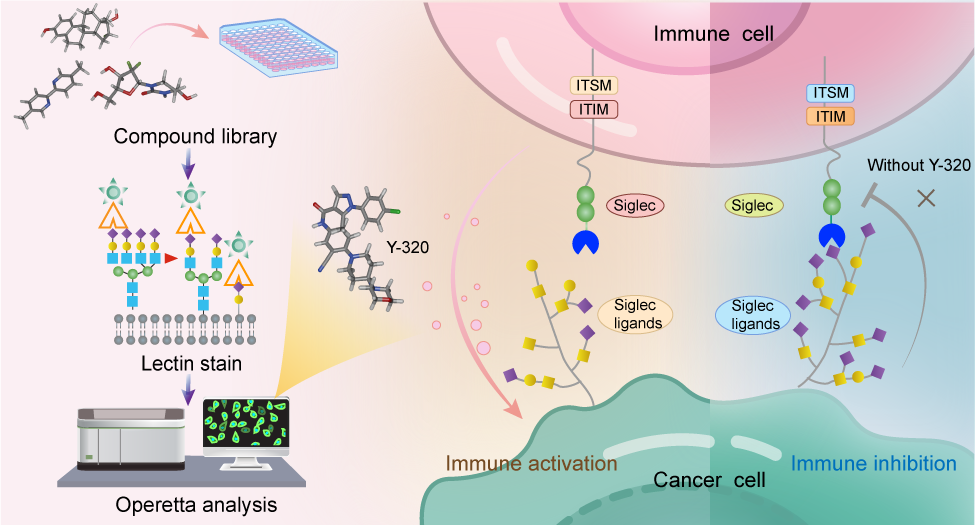
高度唾液酸化是腫瘤細胞的特征標志之一,在癌癥進展中發揮關鍵作用。尤其是,腫瘤細胞表面唾液酸通過與免疫細胞表面的Siglec受體結合,抑制免疫應答,從而促進免疫逃逸。因此,干預唾液酸化過程被認為是開發新型癌癥治療策略的重要方向。目前,針對唾液酸化的大分子干預手段已取得一定進展,但小分子抑制劑的研發仍面臨挑戰。
近日,中國科學院上海有機化學研究所生命過程小分子調控全國重點實驗室俞飚院士團隊和合作者報道了一個迄今最高效的唾液酸化小分子抑制劑,并顯示顯著的免疫微環境激活及抗腫瘤效果。
該研究以具有典型高度唾液酸化表型的胰腺導管腺癌(PDAC)為模型,建立了高效的通量篩選平臺,并以此篩選到可顯著降低腫瘤細胞表面唾液酸化水平的小分子化合物Y-320。進一步的實驗表明,Y-320能夠廣泛抑制腫瘤細胞表面α-2,3/2,6唾液酸化修飾,其半抑制濃度(IC50)達到約200 nM,是經典的泛唾液酸化抑制劑P-3Fax-Neu5Ac的300多倍。分子對接分析顯示,Y-320很可能通過競爭性占據多種唾液酸轉移酶的底物結合口袋而發揮抑制作用。
在多種體內模型中,Y-320表現出顯著的腫瘤生長抑制能力,并可重塑腫瘤免疫微環境。免疫細胞分析揭示,Y-320的抗腫瘤效果依賴于CD8? T細胞與巨噬細胞的協同作用。進一步的動物實驗顯示,Y-320與PD-1抗體聯合應用能夠起到優異的協同治療效果;其抑瘤效果明顯優于單一療法,表明Y-320可有效逆轉PDAC對免疫檢查點阻斷治療的耐藥性。
綜上,該研究不僅提供了一個研究體內唾液酸化功能的實用工具小分子;而且,驗證了唾液酸化抑制作為一種新型糖免疫檢查點策略在治療PDAC及其它免疫治療耐受型腫瘤中的潛力;也表明Y-320具備良好的臨床轉化前景,有望為癌癥免疫治療提供新方案。
上述工作已以“A potent oral sialylation inhibitor augments the immunotherapy in pancreatic ductal adenocarcinoma” 為標題在ACS Central Science期刊發表。原文鏈接:https://pubs.acs.org/doi/10.1021/acscentsci.5c00939。
中國科學院上海有機化學研究所博士后牟珈慧為該研究的第一作者,上海藥物所博士生陳潤秋和有機所博士生代子豪為共同第一作者。中國科學院上海有機化學研究所俞飚院士為本研究的通訊作者,有機所王婧研究員、上海藥物研究所宮麗崑研究員和龍益如博士為共同通訊作者。該工作還得到了上海科技大學白芳研究員、有機所房鵬飛研究員以及上海科技大學博士生楊皓、杭州高等研究院研究生索菲亞珊和李一藩等的支持。該工作得到了國家自然科學基金委、科技部、中國科學院等項目和基金的資助。

 日韩欧美精品三级,激情婷婷亚洲,日韩午夜一区,夜夜夜精品看看
主站蜘蛛池模板:
不卡一区中文字幕|
欧美色图免费看|
日本一区二区三区视频|
91精品国产综合久久香蕉的用户体验|
国产午夜精品免费一区二区三区|
最新国产精品|
98国产高清一区|
国产二区精品|
亚洲国产成人久久综合|
欧美呦呦网站|
国产欧美日韩在线|
国产精品久久天天影视|
久久精品国产一区二区三区日韩|
欧美色播在线播放|
日韩在线观看|
国产午夜精品一区二区三区欧美|
国产一区二区在线影院|
亚洲精品久久久久久久久久久久久
|
国产99久久久国产精品免费看
|
国产在线拍揄自揄视频不卡99|
91精品欧美一区二区三区综合在|
久久这里只有精品视频首页|
欧美日韩国产999|
日韩电影中文字幕一区|
欧美日韩精品免费在线观看视频|
成人精品视频|
国产精品久久久久一区二区三区厕所
|
在线成人激情|
精品久久久久一区|
国产午夜精品在线观看|
日韩成人激情|
亚洲电影一区二区三区|
国产一区二区三区电影在线观看|
欧美极品中文字幕|
亚洲精品一区二区三|
国产日韩精品一区二区|
色中色综合网|
中文网丁香综合网|
日韩成人精品一区二区|
亚洲精品中文综合第一页|
精品一区二区综合|
日韩欧美精品三级,激情婷婷亚洲,日韩午夜一区,夜夜夜精品看看
主站蜘蛛池模板:
不卡一区中文字幕|
欧美色图免费看|
日本一区二区三区视频|
91精品国产综合久久香蕉的用户体验|
国产午夜精品免费一区二区三区|
最新国产精品|
98国产高清一区|
国产二区精品|
亚洲国产成人久久综合|
欧美呦呦网站|
国产欧美日韩在线|
国产精品久久天天影视|
久久精品国产一区二区三区日韩|
欧美色播在线播放|
日韩在线观看|
国产午夜精品一区二区三区欧美|
国产一区二区在线影院|
亚洲精品久久久久久久久久久久久
|
国产99久久久国产精品免费看
|
国产在线拍揄自揄视频不卡99|
91精品欧美一区二区三区综合在|
久久这里只有精品视频首页|
欧美日韩国产999|
日韩电影中文字幕一区|
欧美日韩精品免费在线观看视频|
成人精品视频|
国产精品久久久久一区二区三区厕所
|
在线成人激情|
精品久久久久一区|
国产午夜精品在线观看|
日韩成人激情|
亚洲电影一区二区三区|
国产一区二区三区电影在线观看|
欧美极品中文字幕|
亚洲精品一区二区三|
国产日韩精品一区二区|
色中色综合网|
中文网丁香综合网|
日韩成人精品一区二区|
亚洲精品中文综合第一页|
精品一区二区综合|