近日,中國科學院上海藥物研究所周宇研究員與中科中山藥物創新研究院李平研究員、尹萬超研究員,上海交通大學程曦研究員,中南大學湘雅醫院唐北沙教授等團隊合作,通過針對性的化合物結構改造,獲得DCY1020等多個活性更優的新化合物,并首次解析出多個激活劑分子與溶酶體TMEM175氫離子通道蛋白的復合物冷凍電鏡結構,系統闡明了該類激活劑調控TMEM175氫離子通道的分子機制,并驗證了TMEM175激活劑對PD個性化治療潛力。相關成果于2025年8月26日,以“Structural insights into the activation of TMEM175 by small molecule”為題在線發表于《Neuron》期刊。
研究團隊基于前期研究發現的TMEM175小分子激活劑先導化合物,通過初步結構優化和構效關系研究,開發出DCY1020等多個高活性的TMEM175激動劑,并成功解析出DCY1020-TMEM175復合物冷凍電鏡結構,再結合位點特異性點突變、溶酶體膜片鉗記錄等技術,精確闡明了激活劑DCY1020調控TMEM175氫離子通道的結構基礎和分子機制。基于DCY1020-TMEM175蛋白調控模式,研究團隊進一步運用AI賦能的藥物設計策略開展了深入的化學結構修飾與優化工作,獲得了活性更優的小分子激活劑DCY1040,并同步發現DCY1040協同激活劑分子TUG-891,解析出DCY1040-TUG-891-TMEM175復合物冷凍電鏡結構,清晰觀察到同一個TMEM175通道蛋白內同時結合了兩個小分子化合物,TUG-891位于另一個全新的結合口袋。經分子動力學模擬及溶酶體膜片鉗實驗,闡明了DCY1040和TUG-891分子動態調控TMEM175通道構象變化的分子機制。
研究團隊進一步通過細胞和動物疾病模型,評估了TMEM175激活劑分子改善PD的藥效。在神經元疾病模型中,DCY1040和TUG-891小分子顯著促進了細胞對a-突觸核蛋白聚集體的清除效率。在斑馬魚疾病模型中,a-突觸核蛋白的溶酶體清除過程能夠被DCY1040和TUG-891小分子加速,其相關的運動行為學障礙也得到了顯著改善。上述藥效學結果初步驗證了靶向溶酶體TMEM175氫離子通道有望開發出PD治療藥物。
通過中南大學湘雅醫院唐北沙教授團隊合作,該研究還探索了我國PD患者TMEM175多個臨床突變體,發現多個臨床突變與TMEM175離子通道功能下調密切相關。深入研究發現,DCY1040等化合物可顯著恢復多個功能下調型臨床變異的通道功能。特別的是,在攜帶TMEM175臨床變異的多種帕金森病患臨床樣本上,DCY1040和TUG-891均表現出調控溶酶體酸化的能力,為未來PD個性化治療藥物開發打下了堅實的基礎。
總體而言,該研究初步完成了靶向溶酶體氫離子通道TMEM175的抗PD藥物研發概念驗證工作,為未來PD對因治療藥物的開發和個性化治療奠定了基礎。
中科中山藥物創新研究院李平研究員、上海藥物所周宇研究員、中科中山藥物創新研究院尹萬超研究員、上海交通大學程曦研究員、中南大學湘雅醫院唐北沙教授為本文共同通訊作者。中科中山藥物創新研究院朱學武博士、平美萱,上海藥物所劉恒博士、喻婷、侯鑫嬌,中南大學湘雅醫院劉振華教授,南京中醫大學江忠文,南方醫科大學黎嬋婧為本文共同第一作者。該研究得到了浙江大學徐浩新教授、胡美欽教授的悉心指導,以及上海藥物所高峰電鏡中心的支持。
原文鏈接:https://doi.org/10.1016/j.neuron.2025.07.029
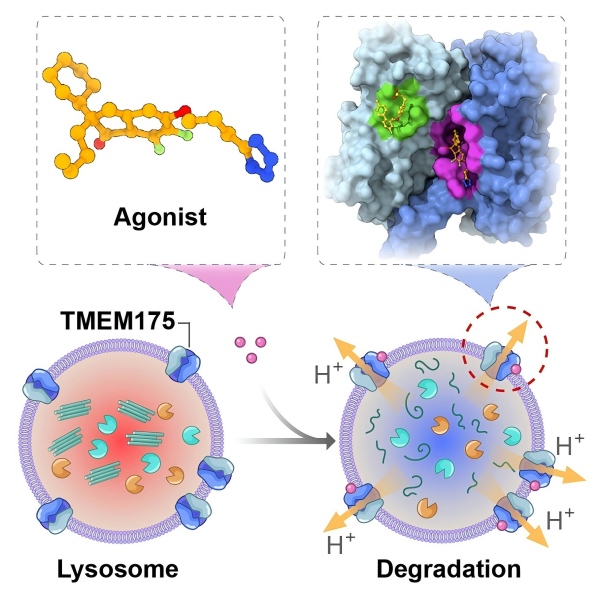
溶酶體TMEM175離子通道新分子

 日韩欧美精品三级,激情婷婷亚洲,日韩午夜一区,夜夜夜精品看看
主站蜘蛛池模板:
国产99亚洲|
欧美国产一区二区三区|
久久99性xxx老妇胖精品|
亚洲一区二区三区在线播放|
亚洲精品成人影院|
一区二区三区视频在线播放|
中文字幕乱码亚洲无线精品一区
|
久久久久国产精品免费网站
|
2023国产精品久久久精品双|
天天做天天爱天天综合网2021|
久久精品中文字幕电影|
91精品欧美一区二区三区综合在|
91tv精品福利国产在线观看|
亚洲一级毛片|
国产精品嫩草影院在线看|
欧美精品一区在线观看|
欧美一区二区|
99精品视频免费|
亚洲欧美日韩一区二区|
久久99亚洲精品|
精品亚洲aⅴ乱码一区二区三区|
欧美限制电影|
国产精品电影网|
在线看片不卡|
欧美日韩视频在线|
色综合久久网|
亚洲香蕉在线观看|
国产中文字幕一区二区三区|
日韩精品999|
91豆麻精品91久久久久久|
国产精品日韩欧美一区二区三区|
欧美色图一区|
国产精品久久久久久久久久|
亚洲老妇激情|
精品1区2区3区|
婷婷综合亚洲|
狠狠色丁香婷婷综合影院|
欧美激情一级欧美精品|
免费一区二区三区在在线视频|
成人高清av|
亚洲美女区一区|
日韩欧美精品三级,激情婷婷亚洲,日韩午夜一区,夜夜夜精品看看
主站蜘蛛池模板:
国产99亚洲|
欧美国产一区二区三区|
久久99性xxx老妇胖精品|
亚洲一区二区三区在线播放|
亚洲精品成人影院|
一区二区三区视频在线播放|
中文字幕乱码亚洲无线精品一区
|
久久久久国产精品免费网站
|
2023国产精品久久久精品双|
天天做天天爱天天综合网2021|
久久精品中文字幕电影|
91精品欧美一区二区三区综合在|
91tv精品福利国产在线观看|
亚洲一级毛片|
国产精品嫩草影院在线看|
欧美精品一区在线观看|
欧美一区二区|
99精品视频免费|
亚洲欧美日韩一区二区|
久久99亚洲精品|
精品亚洲aⅴ乱码一区二区三区|
欧美限制电影|
国产精品电影网|
在线看片不卡|
欧美日韩视频在线|
色综合久久网|
亚洲香蕉在线观看|
国产中文字幕一区二区三区|
日韩精品999|
91豆麻精品91久久久久久|
国产精品日韩欧美一区二区三区|
欧美色图一区|
国产精品久久久久久久久久|
亚洲老妇激情|
精品1区2区3区|
婷婷综合亚洲|
狠狠色丁香婷婷综合影院|
欧美激情一级欧美精品|
免费一区二区三区在在线视频|
成人高清av|
亚洲美女区一区|