1977年,諾貝爾生理學或醫學獎授予Roger Guillemin和Andrew Schally,以表彰他們發現并合成“生殖密碼”——促性腺激素釋放激素(GnRH)。這一里程碑式的成果揭開了生命繁衍的分子奧秘,也為現代生殖醫學和畜牧業帶來了革命性變革。近半個世紀后,GnRH的受體(GnRHR)依然是科學家攻堅的焦點:它是不孕癥、前列腺癌等生殖系統疾病的治療靶點,甚至還是畜牧業中高效繁殖的“秘密武器”。大眾所熟知的亮丙瑞林、戈舍瑞林就是靶向GnRHR的多肽類似物,它們在治療前列腺癌及乳腺癌領域擁有著極高的市場份額。低表達和極不穩定的GnRHR精密地調控著人體的生殖平衡,然而,這也對蛋白表達、純化以及結構解析提出了難題。GnRHR如何精確識別激素信號并激活下游通路的機制尚不清楚。
GnRHR是下丘腦-垂體-性腺軸(HPG)的核心受體,通過調控促性腺激素(LH和FSH)的分泌控制生殖功能。GnRHR的異常激活或抑制與不孕癥、性早熟、子宮內膜異位癥和前列腺癌等疾病密切相關。盡管GnRH類似物如亮丙瑞林、戈舍瑞林已廣泛應用于臨床,但其快速降解和脫靶效應限制了療效。GnRH如何激活 GnRHR的結構信息長期缺失,阻礙了靶向藥物的理性設計(圖1)。
2025年6月17日,中國科學院上海藥物研究所段佳研究員團隊聯合徐華強研究員團隊,在《美國國家科學院院刊》(PNAS)在線發表了題為《Cryo-EM Structures of GnRHR: Foundations for Next-Generation Therapeutics》的研究論文。該研究首次通過高分辨率冷凍電鏡技術解析了豬源(Sus scrofa)和非洲爪蟾源(Xenopus laevis)促性腺激素釋放激素受體(GnRHR)與哺乳動物內源性GnRH及Gq蛋白的激動態復合物結構,并對近10種該靶點藥物分子進行了深入構效關系分析,揭示了GnRH的保守識別機制和受體激活的分子基礎,為開發新一代生殖疾病和癌癥治療藥物提供了關鍵結構模板。
早在6年前,研究團隊便開始嘗試建立人源GnRHR的表達體系。然而,由于人源GnRHR結構上的獨特性——缺乏大多數GPCR所具備的典型Helix 8結構,使得其在體外的高效表達與純化面臨極大挑戰。直到2024年初,段佳研究員在參加第五屆國際促性腺激素及其受體會議期間,受到美國國家科學院院士Wayne Hendrickson報告的啟發,團隊開始嘗試從其他物種中篩選更易表達純化的GnRHR作為研究對象。
GnRHR是一種進化高度保守的基因,廣泛存在于幾乎所有脊椎動物中并執行類似的生理功能。通過跨物種序列比對發現,非哺乳動物的GnRHR通常保留有典型的Helix 8結構,而哺乳動物中則普遍缺失該結構域。基于此差異,研究團隊篩選了兩種與人源GnRHR具有代表性差異的物種:一是與人源GnRHR序列同源性高達91.2%的豬源GnRHR(pGnRHR),另一種是與人源序列差異較大的非洲爪蟾GnRHR(fGnRHR,同源性為44.3%)。最終,團隊成功解析了GnRH激活狀態下,pGnRHR和fGnRHR分別與Gq蛋白結合形成的復合物冷凍電鏡結構,其分辨率分別達到3.18 ?和2.67 ?(圖1)。
結構研究顯示,GnRH在兩種復合物中均以獨特且保守的“倒U形”構象嵌入受體正構口袋,其N端與C端分別插入受體口袋的不同區域,并與跨膜螺旋(TM3、TM5–TM7)及胞外環(ECL2/3)上的關鍵殘基形成特異性相互作用。多物種序列比對結果進一步揭示,該結合口袋周圍的關鍵殘基具有高度保守性,其中如K3.32、Y6.51和Y6.52等殘基通過氫鍵和π–π堆疊相互作用穩定GnRH的結合模式,突顯了GnRH識別在物種進化中的保守特征。與此同時,也觀察到特定物種如fGnRHR在ECL3構象上的差異,提示該區域可能參與了功能精細調控的進化適應。功能實驗證實,結構中揭示的保守殘基對GnRH誘導的信號傳導具有顯著影響(圖2),進一步驗證了結構–功能之間的內在聯系。
基于激動態結構,研究團隊進一步構建并分析了9種已上市GnRH類似物(如曲普瑞林、那法瑞林等)的受體結合構象,系統總結其構效關系(SAR)。他們發現多肽中第6位甘氨酸被D型氨基酸(如D-Trp)取代,可顯著增強其“預折疊”能力,穩定其激動構象(type II’ β-turn),進而提高藥物活性并增強突變耐受性。該發現不僅揭示了GnRH類似物激活受體的分子機制,也為新一代GnRHR靶向藥物優化提供了明確方向。
GnRHR作為調控人類生育與性發育的“中樞開關”,是連接基礎研究與臨床轉化的橋梁。本研究不僅填補了GnRHR激活機制的結構空白,更為新一代小分子與多肽藥物的結構優化與創新開發提供了堅實基礎。未來,依托該結構信息與構效規律,有望開發出更安全、更穩定、作用更精準的GnRH類藥物,造福廣大不孕癥與激素相關腫瘤患者。
中國科學院上海藥物研究所博士生沈詩怡為本文的第一作者。中國科學院上海藥物研究所段佳研究員、徐華強研究員為共同通訊作者。上海市高峰電鏡中心負責了該項研究冷凍電鏡數據的收集。該工作得到中國科學院戰略性先導科技專項、上海市市級科技重大專項、國家自然科學基金、國家重點研發計劃、中國科學院上海分院青年攀登計劃、上海市揚帆計劃等項目資助。
值得一提的是,本研究是段佳、徐華強團隊近年來繼解析LHCGR(Nature, 2021)、FSHR(Nat Commun, 2023)及KISS1R(Cell Reports, 2024)結構之后,在性腺軸(HPG軸)GPCR結構研究與藥物開發領域的又一關鍵成果。研究團隊系統勾勒出從上游(KISS1R)到中樞(GnRHR)再到下游(FSHR/LHCGR)的結構調控圖譜,正在構建完整的結構藥理學框架,推動生殖類疾病的精準治療(圖1)。段佳研究員自2023年獨立建組以來,課題組致力于從結構到功能、從機制到轉化的全鏈條GPCR研究,持續拓展該領域的研究深度與廣度。當前,團隊因科研發展需要,誠摯歡迎具有免疫、代謝、生物信息等學科背景的優秀博士及博士后加盟,共同推動GPCR領域的原創性突破與轉化應用發展。
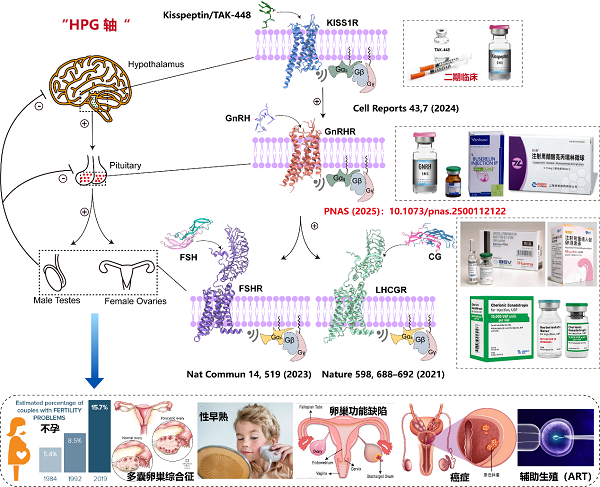
圖1. 位于下丘腦-垂體-性腺軸(HPG)的關鍵GPCR信號、蛋白結構以及臨床藥物
與適應癥
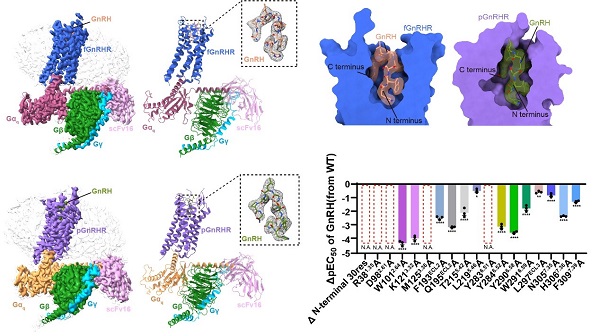
圖2. GnRH與非洲爪蟾源以及豬源GnRHR-Gq復合物的冷凍電鏡結構
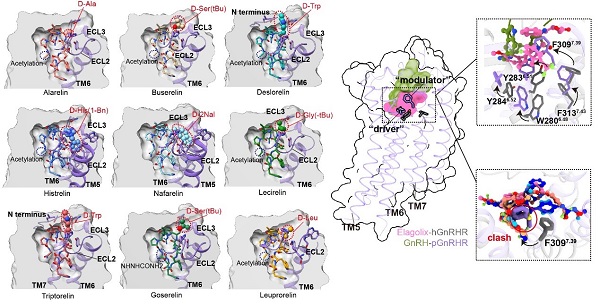
圖3. GnRHR藥物建模與構效關系示意圖

 主站蜘蛛池模板:
大田县|
富源县|
疏附县|
新乡县|
建阳市|
武胜县|
绵阳市|
格尔木市|
会昌县|
昌都县|
湖口县|
甘谷县|
平原县|
通化县|
河津市|
永昌县|
尉氏县|
马关县|
岳西县|
新河县|
汉寿县|
延津县|
唐河县|
桐城市|
逊克县|
永丰县|
沈丘县|
徐水县|
台南县|
兴宁市|
镇康县|
黔西|
澄城县|
琼海市|
连江县|
通山县|
西华县|
宣汉县|
神木县|
景宁|
榆中县|
主站蜘蛛池模板:
大田县|
富源县|
疏附县|
新乡县|
建阳市|
武胜县|
绵阳市|
格尔木市|
会昌县|
昌都县|
湖口县|
甘谷县|
平原县|
通化县|
河津市|
永昌县|
尉氏县|
马关县|
岳西县|
新河县|
汉寿县|
延津县|
唐河县|
桐城市|
逊克县|
永丰县|
沈丘县|
徐水县|
台南县|
兴宁市|
镇康县|
黔西|
澄城县|
琼海市|
连江县|
通山县|
西华县|
宣汉县|
神木县|
景宁|
榆中县|